作者丨崔雪芹
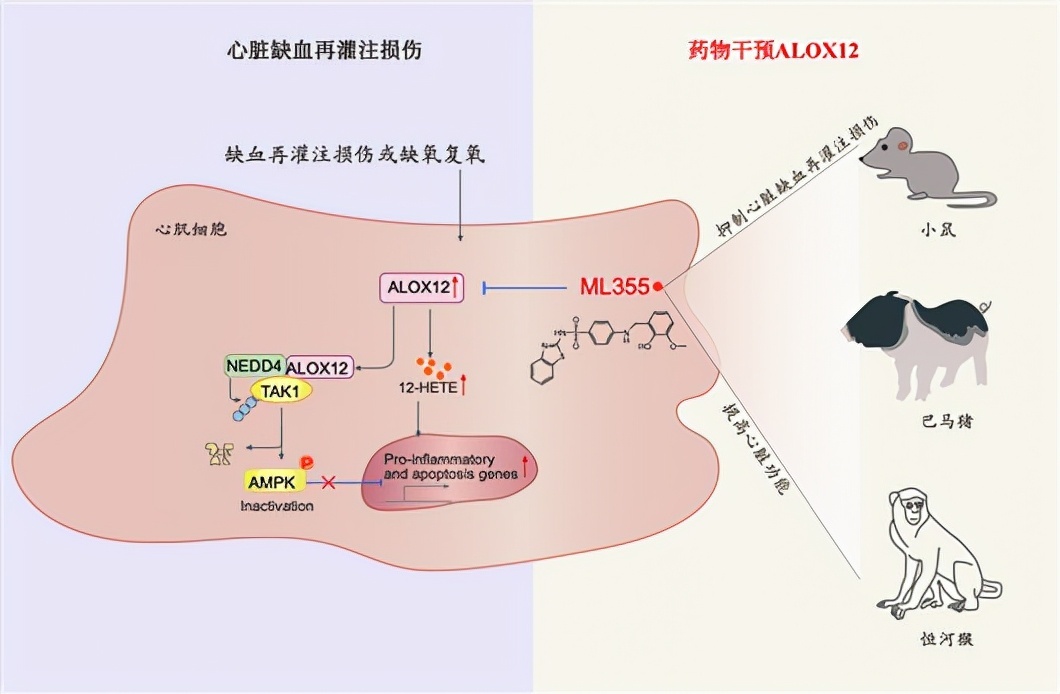
△ALOX12促进心脏缺血再灌注损伤;小分子ML355显著提高小鼠、猪、猴急性心肌缺血再灌注损伤预后。李红良供图
9月17日,武汉大学李红良团队在《细胞代谢》杂志发表最新研究论文,研究者通过临床样本代谢组学筛选和系统功能学验证,首次揭示了ALOX12(花生四烯酸12-脂肪氧化酶)是心脏缺血再灌注损伤的关键驱动分子,发现小分子化合物ML355可有效改善缺血再灌注引起的小鼠、巴马猪和恒河猴的心肌损伤和心功能下降。
急性心肌梗死的高发病率、高死亡率是威胁人类生命健康的重大原因之一。血运重建疗法(药物溶栓、介入、搭桥等)是急性心梗的主要治疗手段,能有效降低患者死亡率。但是,血运重建不可避免的引起缺血再灌注损伤,导致严重的心肌细胞死亡、组织损伤加重、急慢性心衰,甚至死亡。
据统计,心脏缺血再灌注损伤导致术后5年心血管不良事件发生率高达40%,死亡率高达9%~11%。在我国,血运重建治疗不及时、缺血时间延长,进一步加重了心脏缺血再灌注损伤,严重影响患者预后和生存质量。然而,目前没有任何药物可以特异性改善临床心脏缺血再灌注损伤,提高血运重建预后。
心脏缺血再灌注损伤发病机制复杂,但是源头启动因素和根本发病机制不明确,极大限制了特异性靶向治疗药物的开发。
李红良团队研究成果破解了这一难题。
该研究收集急性心梗病人PCI治疗前后以及小鼠、巴马猪、恒河猴心脏缺血再灌注损伤模型的血液样本进行代谢组学,发现花生四烯酸通路代谢物12-HETE在不同物种中均敏感响应心脏缺血再灌注刺激。进一步研究发现,12-HETE上游脂氧合酶ALOX12在再灌注后的心脏中显著上调,明显加重再灌注引起的心功能下降、心肌坏死、心肌重构以及心衰。
该研究的分子机制研究首次提出,ALOX12可直接靶向NEDD4-TAK1抑制AMPK信号通路,该作用不依赖于其产生12-HETE的酶活性。值得注意的是,该研究首次发现ALOX12小分子抑制剂ML355可有效改善小鼠、巴马猪和恒河猴等多物种的心脏缺血再灌注损伤、心脏功能下降和心肌重构。李红良团队的研究成果为深入探索心脏缺血再灌注损伤的关键机制、改善心梗患者血运重建预后、提高患者生存率提供了有力支撑。
“过去十几年,团队在解析重大心血管和代谢性疾病的根本发病机制、筛选调控疾病进程的关键靶点、开发靶向治疗的先导化合物方向进行了系统研究,构建了临床研究、基础研究、转化与先导药物开发等研究体系。”李红良告诉《中国科学报》。
他指出,团队系列研究发现疾病关键调控因子180余个、临床样本验证潜在治疗靶点 40余个、大动物模型验证靶点10余个。上述研究成果发表在国际期刊上共计 200 余篇。
系列研究成果为后续心血管和代谢性疾病的新药开发及临床前研究奠定了重要基础。
此外,李红良团队前期研究成果证实ALOX12-12-HETE-GPR31轴显著促进缺血再灌注导致的肝脏损伤,使用 ALOX12 小分子抑制剂可有效缓解肝脏损伤并提高肝功能(Nat Med. 2018;24:73-83)。该研究工作是上述系列工作的延续,进一步阐明了心肌缺血再灌注损伤的核心驱动因子,揭示了ALOX12在心脏缺血再灌注损伤的功能与作用机制,为提高心梗患者PCI预后提供了新的治疗靶点与策略。



















